小细胞肺癌免疫治疗新一代生物标志物的前沿
研究背景
小细胞肺癌(SCLC)的免疫治疗近年来取得了显著进展,尤其是在广泛期小细胞肺癌(ES-SCLC)中,将程序性细胞死亡配体1(PD-L1)免疫检查点抑制剂加入一线化疗,代表了一种新的标准治疗,改善了生存结果,并提供了长期反应的可能性。尽管非小细胞肺癌(NSCLC)的管理已经变得更加个性化,但ES-SCLC中的生物标志物仍然难以捉摸,我们继续将其视为单一的疾病实体。
ES-SCLC中生物标志物的缺乏反映了在免疫检查点抑制剂治疗中预测结果的更广泛挑战,其中一小部分患者可以获得显著益处,并产生深度和持久的反应。
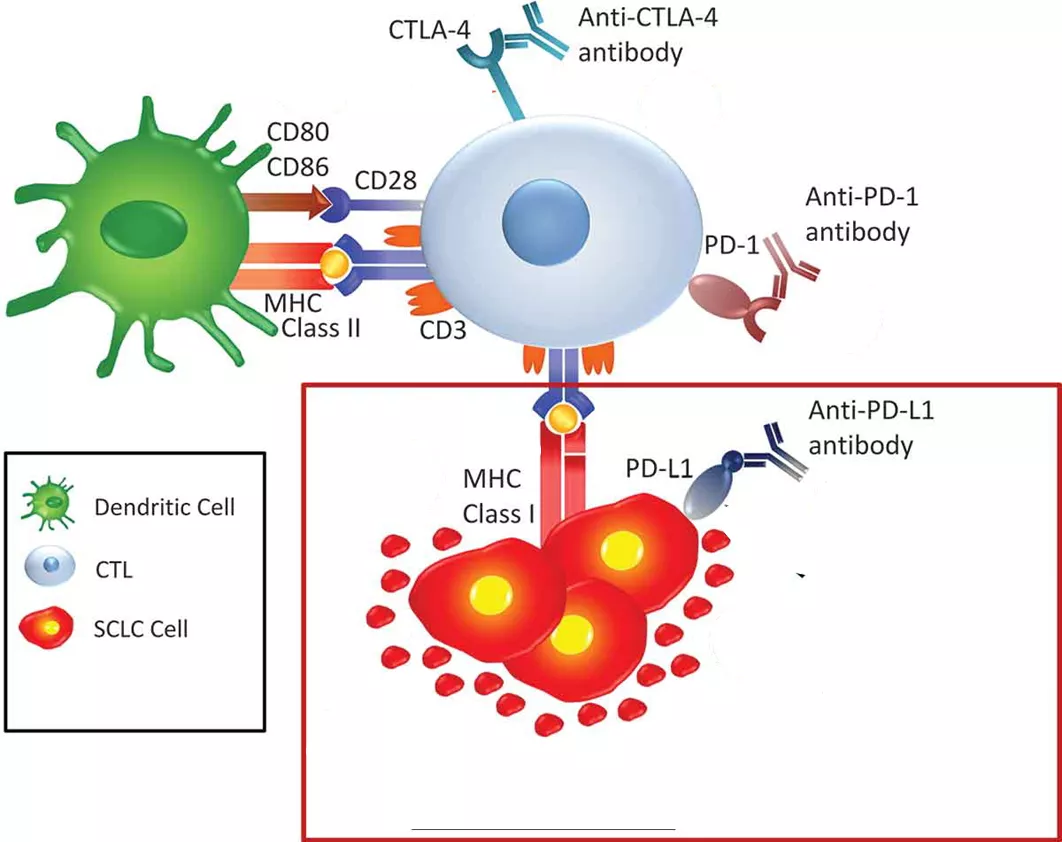
图1: 小细胞肺癌免疫治疗机制示意图
CASPIAN试验分析
Paz-Ares等人报告了III期CASPIAN试验的探索性生物标志物分析,评估了PD-L1表达和肿瘤突变负荷(TMB)在单检查点阻断(度伐利尤单抗)和双检查点阻断(度伐利尤单抗和曲美木单抗)加入依托泊苷和铂类(EP)化疗中的预测作用。CASPIAN试验表明,单检查点抑制加入EP化疗用于ES-SCLC的一线治疗改善了生存率,并确立了度伐利尤单抗与阿特珠单抗联合EP化疗作为ES-SCLC的标准治疗。试验组相对于对照组表现不佳,CTLA4抑制尚未在SCLC中找到位置。
PD-L1与TMB标志物
在此分析中,Paz-Ares等人报告了使用Ventana SP263免疫组织化学(IHC)检测在肿瘤细胞(TC)和肿瘤相关免疫细胞(IC)中的PD-L1表达,将阳性定义为细胞中的染色。PD-L1阳性在SCLC TC中的发生率相对较低;IC更可能显示PD-L1表达,但IC PD-L1阳性也仅在少数SCLC组织样本中观察到。对CASPIAN研究人群中的肿瘤样本进行的检测与这一先前知识一致,显示PD-L1阳性在5.7%的TC、25.8%的IC和28.3%的TC或IC中的发生率。
在分析PD-L1表达作为预测性生物标志物时,未发现其在预测加入度伐利尤单抗后的总体生存率方面有用,总体生存风险比(HR)描述了加入度伐利尤单抗的益处,PD-L1阳性和阴性队列分别为0.61和0.63。为了将这一发现置于背景中,PD-L1也未能在另外两项大型III期ES-SCLC临床试验(IMpower 133和KEYNOTE 604)中成为预测性生物标志物,这两项试验中单抗PD(L)1药物被加入EP化疗。
分子亚型研究
尽管临床相关性较低,但Paz-Ares及其同事的这项分析确实表明,PD-L1表达可能作为双检查点抑制的预测性生物标志物。具体而言,在接受度伐利尤单抗和EP的队列中,与PD-L1 <1亚组相比,在PD-L1 ≥1亚组中,添加度伐利尤单抗和曲美木单抗后,基于TC(HR 0.42 vs. 0.76)、IC(HR 0.53 vs. 0.88)以及TC或IC(HR 0.50 vs. 0.91)的HR有所改善。由于这是一项事后亚组分析,且仅有54.4%的试验人群的组织适合评估生物标志物,因此这些发现只能被视为假设生成。
SCLC分子亚型
过去五年中,对SCLC分子特征的研究导致了四种不同的SCLC分子亚型的出现:SCLC-A、N、P和I。前三种分别与特定转录因子ASCL1、NEUROD1和POU2F3的过表达相关,而SCLC-I则与这些转录因子的过表达无关,但与高IC浸润和细胞毒性活性相关。
自当前分析发表以来,谢及其同事对CASPIAN试验的分子转录分析已发表,进一步证实了帕斯-阿雷斯等人的发现。该模型已被盖伊等人在IMPOWER 133的探索性分析中验证,其中发现SCLC-I亚型对单一免疫检查点抑制的良好反应具有预后意义,尽管不具有预测性。谢等人在CASPIAN试验人群中也复制了类似的发现,进一步的双检查点抑制臂探索性分析显示,SCLC-I亚组在接受度伐利尤单抗和曲美木单抗治疗时,报告的中位生存期最高为30.8个月。然而,由于该亚型在严格标准下的罕见性,无法进行统计比较。
在盖伊等人的工作基础上,谢等人发现了与SCLC-I肿瘤相关的炎症反应RNA特征,这些特征也预测了良好的双免疫治疗反应。特别是,在接受度伐利尤单抗和曲美木单抗治疗的患者中,存在与不存在T细胞炎症RNA特征在总生存期(OS)中具有统计学显著性的HR为0.36,具有T细胞炎症特征的患者在接受度伐利尤单抗和曲美木单抗 + EP治疗时中位生存期为30.8个月。
未来研究方向
Paz-Ares等人进行的分析还包括TMB,该指标在35.2%的意向治疗(ITT)试验人群中可评估。尽管TMB作为检查点抑制剂反应的生物标志物已被广泛研究,但其作用在不同肿瘤类型中并不一致,并且在IMPOWER 133的一线ES-SCLC分析中先前显示没有预测或预后价值,纳贝特等人进一步证明TMB与当前对分子亚型的理解无关。当前分析证实了之前的发现,即无论截止值如何,TMB对治疗组之间的生存率没有影响,同时还表明TMB值和PD-L1表达似乎相互独立,这支持了PD-L1和TMB可能代表免疫反应的不同独立方面的假设,深入理解免疫反应可能需要理解多个相互作用因素。
图2: SCLC生物标志物研究进展与未来方向
研究结论
Paz-Ares等人最近发表的结果进一步证实,PD-L1和TMB并非我们在ES-SCLC中寻找的预测性生物标志物。此外,免疫检查点抑制剂可能引发不可预测且可能危及生命的免疫相关不良反应,而我们距离能够预测这些不良反应的生物标志物还很遥远。然而,临床试验与转化生物标志物研究之间的合作为我们提供了窥见新一代生物标志物的机会。
在确定如何最佳使用免疫检查点抑制剂以改善SCLC预后方面,一个主要挑战是相对"冷"的肿瘤微环境,这也可能是PD-L1和TMB作为有用生物标志物缺乏效用的原因。具体而言,SCLC通常通过下调或沉默主要组织相容性复合体(MHC)I类抗原加工和呈递来减少抗原呈递,70-80%的SCLC肿瘤标本显示MHC I类表达缺失。因此,高TMB可能并不转化为更多的新抗原被呈递给T细胞。
此外,与非小细胞肺癌(NSCLC)相比,SCLC肿瘤微环境中CD8 T细胞的丰度较低,而免疫抑制性IC细胞群在SCLC中增加。有数据显示,SCLC的有用生物标志物可能来自反映这些免疫抑制过程相对活性的蛋白质组学分析,而宏基因组分析可能揭示癌症免疫反应中多种因素的相互作用,未来SCLC的治疗可能取决于我们能否将"冷"肿瘤微环境转变为"热"微环境。
